Madrid, viernes 10 de febrero de 2012.
- Alfa2-macroglobulina actúa como una trampa para las proteínas encargadas de cortar otras enzimas.
- Ha sido publicado en el último número de la revista Angewandte Chemie
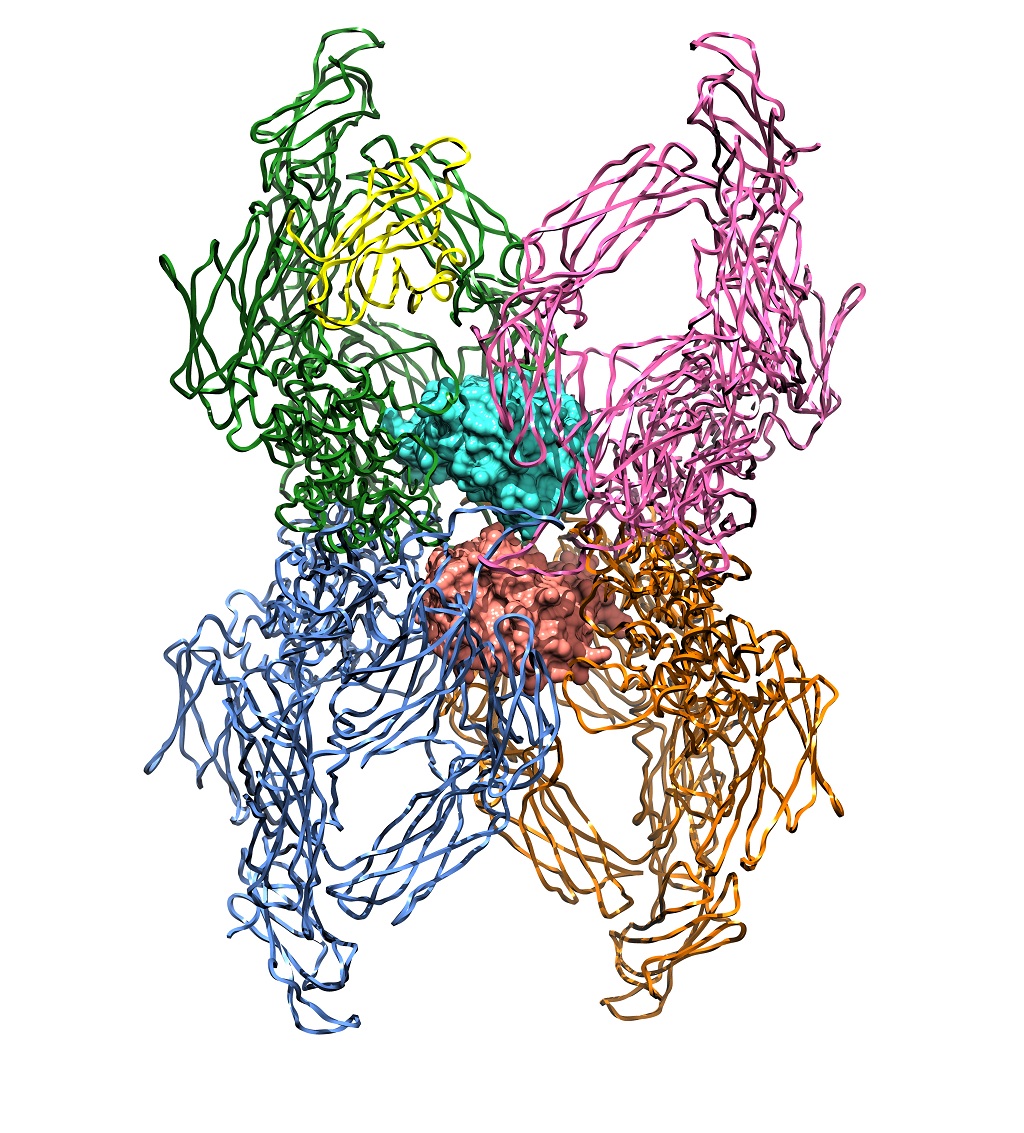 Un estudio internacional liderado por el Consejo Superior de Investigaciones Científicas (CSIC) ha desvelado, mediante cristalografía de rayos X, la estructura tridimensional de la partícula alfa2‐macroglobulina. Esta proteína es un complejo inhibidor gigante que se encuentra en la sangre y es capaz de bloquear la acción de proteinasas (enzimas encargadas de cortar otras proteínas) de varios tipos. El descubrimiento del detalle de su estructura aporta datos que podrían ayudar en la investigación de enfermedades como el Alzheimer, el cáncer o el sida. El estudio ha sido publicado en el último número de la revista Angewandte Chemie.
Un estudio internacional liderado por el Consejo Superior de Investigaciones Científicas (CSIC) ha desvelado, mediante cristalografía de rayos X, la estructura tridimensional de la partícula alfa2‐macroglobulina. Esta proteína es un complejo inhibidor gigante que se encuentra en la sangre y es capaz de bloquear la acción de proteinasas (enzimas encargadas de cortar otras proteínas) de varios tipos. El descubrimiento del detalle de su estructura aporta datos que podrían ayudar en la investigación de enfermedades como el Alzheimer, el cáncer o el sida. El estudio ha sido publicado en el último número de la revista Angewandte Chemie.
“Lo novedosos de este inhibidor, que forma una gran cavidad central, es que atrapa sus presas en su interior mediante un sofisticado mecanismo, que recuerda al de las plantas carnívoras: un corte en una región anzuelo desencadena toda una serie de cambios a gran escala que hacen que la trampa se cierre y la proteinasa quede atrapada”, explica el investigador del CSIC Francesc Xavier Gomis, del Instituto de Biología Molecular de Barcelona.
Una vez cerrada, los cambios estructurales en la partícula inhibidora hacen que sea reconocida por receptores extracelulares de varios tipos de células. Este hecho hace que se internalice y sea degradada por los lisosomas de la célula. “El fallo en la regulación de las proteinasas puede dar lugar a procesos patológicos. El cáncer y la metástasis, el Alzheimer, las enfermedades cardiovasculares e inflamatorias, los procesos infecciosos por microorganismos, como la peste, el SIDA, el cólera, la malaria o la enfermedad de Chagas son algunos de los ejemplos de enfermedades que contemplan o se deben a la actuación nociva, errónea o descontrolada de proteinasas”, añade Gomis.
Los investigadores de este estudio han llegado a sus resultados mediante la técnica experimental de la cristalografía de proteínas. Este método requiere la purificación y aislamiento de una proteína mediante técnicas cromatográficas. Una vez se ha obtenido la proteína pura, se cristaliza y los microcristales resultantes se analizan con radiación de rayos X, que permiten resolver la estructura tridimensional.
Función de las proteinasas “Una proteinasa es un enzima que corta otras proteínas, como las que tenemos en el tracto digestivo y que descomponen las proteínas que nos comemos. Otras participan en la complicada cascada de coagulación de la sangre y la fibrinólisis. Otras en emplean en remodelación de tejidos, como ocurre en procesos postmestruales, desarrollo embrionario, etc. Prácticamente no hay proceso biológico en el que no intervenga al menos una proteinasa. Como estas enzimas cortan otras proteínas, es muy importante que estén regulados de forma muy estricta y ahí es donde juegan un papel importantísimo los inhibidores”, concluye el investigador del CSIC.
Aniebrys Marrero, Stephane Duquerroy, Stefano Trapani, Theodoros Goulas, Tibisay Guevara, Gregers R. Andersen, Jorge Navaza, Lars Sottrup‐Jensen y F. Xavier Gomis‐Rüth. The crystal structure of human alpha2‐macroglobulin reveals a unique molecular cage. Angewandte Chemie. DOI: 10.1002/anie.201109104